Resumo de quimica: Teorias Atômicas II
Teoria de Rutherford
No começo do século XX Ernest Rutherford realizou experimentos com o elemento radioativo polônio. Simplificadamente ele acondicionou finíssimas folhas de ouro na frente de uma amostra de polônio (emite partículas alfa – radiação positiva) e ao fundo uma tela fluorescente, para determinar o desvio das partículas.
Caso o átomo fosse maciço, todas as partículas ricocheteariam, mas não foi isso que ocorreu. Rutherford observou que algumas partículas sofreram desvio da folha de ouro, mas a maioria atravessou a folha sem nenhum desvio. Em vista disso ele concluiu que:
– o átomo deveria apresentar espaço vazio (por isso que as partículas alfa atravessaram as folhas de ouro) e um núcleo positivo (explicaria o ricocheteamento das partículas alfa também positivas);
– ao redor do núcleo deveriam estar os elétrons com cargas negativas, neutralizando assim o átomo e promovendo os desvios das partículas.
Para explicar a estabilidade do núcleo, James Chadwick propôs a existência de uma partícula sem carga: o nêutron.
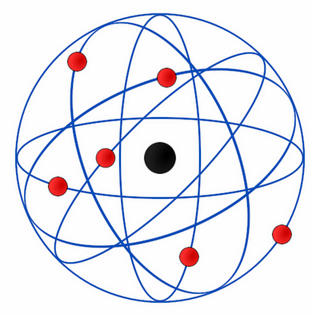
Figura 1 – Modelo de Rutherford
Teoria de Rutherford – Bohr
Como aconteceu com os modelos atômicos anteriores, novos experimentos colocaram em cheque o modelo descrito de Rutherford. Para explicá-los precisamos nos lembrar do espectro eletromagnético.
Este é formado por ondas eletromagnéticas de diferentes frequências e consequentemente diferentes comprimentos de onda. Se a luz de uma lâmpada incandescente atravessar um prisma, essa luz será decomposta em várias cores, e será detectada por um filme fotográfico na forma de um espectro contínuo (Figura 2).
No entanto, se no lugar da lâmpada incandescente, utilizarmos um tubo de raio catódico com apenas gás hidrogênio não veríamos um espectro contínuo e sim linhas espectrais.
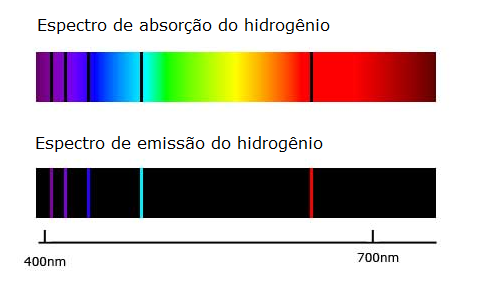
Figura 2 – Espectros da luz visível e do hidrogênio
Os espectros de linhas são característicos para cada elemento químico e, inclusive, serve como um método de detecção de elementos.
O modelo de Rutherford não explicava a existência dos espectros de linhas. Então Niels Bohr propôs um modelo mais completo onde diz que:
– os elétrons movem-se ao redor do núcleo em trajetórias circulares em camadas ou níveis. Cada camada possui uma determinada energia e um elétron pode absorver energia para passar para uma camada mais energética, ou ainda liberar energia para passar para uma camada de menor energia. Arnold Sommerfeld aprimorou esse modelo realizando experimentos com elementos mais complexos que o hidrogênio e concluiu que os níveis de energia são formados por subníveis.
Modelo de orbitais atômicos
Novos experimentos surgiram e o modelo de que o elétron era uma partícula já não era mais suficiente. Nessa época já se tinha a ideia da dualidade da partícula-onda da luz. Então o francês Louis De Broglie propôs que uma partícula (elétron) também poderia ter essa dualidade e ser considerada uma onda.
Adicionalmente a isso, o elétron teria um tamanho ínfimo e por isso seria impossível determinar sua posição ou sua velocidade, pois os métodos de detecção alterariam essas determinações (principio da incerteza ou de Heinsenberg).
Com isso, Erwin Schrodinger determinou, através de cálculos, uma região no espaço ao redor do núcleo onde é máxima a probabilidade de se encontrar um elétron. À essa região deu-se o nome de orbital. Apesar de esse modelo ser constantemente complementado, ainda é o mais aceito atualmente.






