Resumo de quimica: Compostos carbonílicos - Propriedades Físicas de Aldeídos e Cetona
Propriedades Físicas de Aldeídos e Cetona
Temperatura de fusão e ebulição:
Ambos os compostos apresentam em comum a carbonila, a presença dessa função em uma molécula orgânica gera uma polaridade , como demonstrado abaixo:
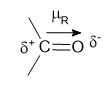
Essa polaridade faz com que a molécula faça interações intermoleculares do tipo dipolo permanente - dipolo permanente (Dp-Dp).
Devido a essa interação intermolecular, os aldeídos e cetonas tendem a apresentar temperatura de fusão e ebulição superiores aos dos hidrocarbonetos. Além disso, devido a essa mesma interação eles tendem a apresentar temperatura de fusão e ebulição inferiores a compostos como álcoois e fenóis .
Solubilidade em água:
Apesar dos aldeídos e cetonas não formarem ligações de hidrogênio entre si, são capazes de formar ligação de hidrogênio com a água como demonstrado abaixo:
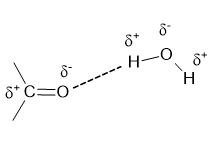
Essa interação intermolecular entre aldeídos e cetonas com a água explica , alta solubilidade desse composto com esse solvente. Vale a pena ressaltar a solubilidade diminui com o aumento da cadeia carbônica de composto para composto.






