(Fuvest 2017 - 2fase - 2 dia)A determinao da massa
(Fuvest 2017 - 2ª fase - 2º dia)
A determinação da massa da molécula de insulina é parte do estudo de sua estrutura. Para medir essa massa, as moléculas de insulina são previamente ionizadas, adquirindo, cada molécula, a carga de um elétron. Esses íons (I) são liberados com velocidade inicial nula a partir de uma amostra submetida a um potencial V = -20 kV. Os íons são acelerados devido à diferença de potencial entre a amostra e um tubo metálico, em potencial nulo, no qual passam a se mover com velocidade constante. Para a calibração da medida, adicionase à amostra um material padrão cujas moléculas também são ionizadas, adquirindo, cada uma, a carga de um elétron; esses íons (P) têm massa conhecida igual a 2846 u. A situação está esquematizada na figura.
a) Determine a energia cinética E dos íons, quando estão dentro do tubo.
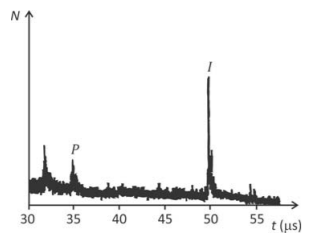
O gráfico na página de respostas mostra o número N de íons em função do tempo t despendido para percorrerem o comprimento L do tubo. Determine
b) a partir dos tempos indicados no gráfico, a razão \(R_{v}=\frac{v_{I}}{v_{p}}\) entre os módulos das velocidade \(v_{1}\) , de um íon de insulina, e \(v_{p}\) , de um íon P, em movimento dentro do tubo;
c) a razão \(R_{m}= \frac{m_{I}}{m_{p}}\) entre as massas \(m_{I}\) e \(m_{p}\), , respectivamente, de um íon de insulina e de um íon P
d) a massa \(m_{I}\) de um íon de insulina, em unidades de massa atômica (u)