(FUVEST - 2022 - 2 FASE)Para possibilitar a explor
(FUVEST - 2022 - 2ª FASE)
Para possibilitar a exploração de Marte, é necessário viabilizar a viagem de retorno à Terra. Uma das formas de tornar os voos de retorno possíveis é produzir combustível a partir da água encontrada em Marte. Para tanto, o hidrogênio seria gerado por eletrólise da água e, posteriormente, utilizado na reação de Sabatier. Nessa reação, o combustível é gerado pela reação do hidrogênio com dióxido de carbono em temperaturas e pressões elevadas na presença de um catalisador de níquel, resultando na produção de metano e água e na liberação de aproximadamente 165 kJ de energia por mol de CO2.
a) No gráfico da folha de respostas, está representada a quantidade de metano gerado pela reação de Sabatier em função do tempo na temperatura T1, depois que o equilíbrio foi estabelecido. Nesse mesmo gráfico, represente a quantidade de metano em função do tempo em uma temperatura T2 maior que T1, após o estabelecimento do equilíbrio.
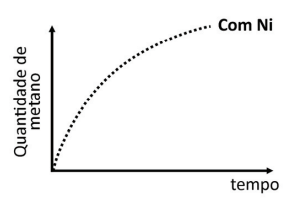
b) No gráfico da folha de respostas, está representada a quantidade de metano gerado pela reação de Sabatier em função do tempo na presença de Ni. No mesmo gráfico, represente a quantidade de metano esperada em função do tempo na ausência de Ni. Explique o efeito do catalisador na energia de ativação da reação de Sabatier.
c) Escreva a equação balanceada da reação de Sabatier. Considerando apenas a composição atmosférica da Terra e de Marte apresentada na tabela a seguir, explique, com base nesse equilíbrio químico, por que essa reação não seria indicada para gerar metano na Terra.

Gráfico do item A:
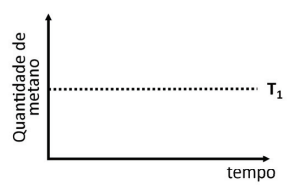
Gráfico do item B: