(FUVEST - 2024)Para gerar hidrognio, foi utilizado
(FUVEST - 2024)
Para gerar hidrogênio, foi utilizado o aparato ilustrado na figura.
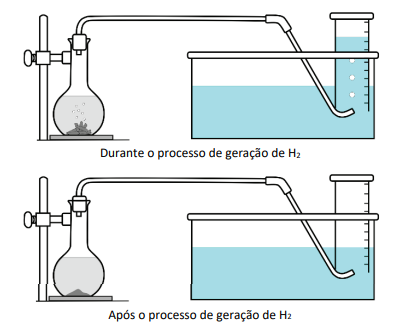
Ao frasco à esquerda adicionou-se uma quantidade prédeterminada de raspas de zinco metálico e ácido clorídrico. Em seguida, o frasco foi fechado com uma rolha conectada a uma tubulação. À medida que o hidrogênio é produzido pela reação \(Zn^0 (s) + 2H^+ (aq) \rightarrow Zn^{2+}(aq) + H_2(g)\), o gás se acumula em uma proveta previamente cheia de água. Dado que a solubilidade do hidrogênio na água é desprezível, o volume ocupado pelo gás na proveta corresponde ao volume de hidrogênio produzido durante a reação.
Considerando que, nas condições do experimento, foram gerados 49,8 mL de hidrogênio, qual a quantidade de Zn metálico, em gramas, que de fato reagiu?
Note e adote: Volume molar do gás ideal nas condições do experimento = 24,9 L.
Massa molar do Zn = 65,4 g/mol.
0,07
0,13
0,26
0,29
0,48


