(UFJF - 2019)O fosgnio, COCl2, um composto organoc
(UFJF - 2019)
O fosgênio, COCl2, é um composto organoclorado tóxico e corrosivo, porém, importante na indústria de polímeros, corantes e produtos farmacêuticos. O estudo da reação reversível de produção do fosgênio determinou a entalpia de formação (reação direta) como sendo -57kJ/mol. Considere a decomposição do COCl2 (reação inversa) ocorrendo sob duas condições: no primeiro caso (Condição A) a energia de ativação da reação de decomposição do COCl2 foi de +70kJ/mol, enquanto no segundo caso (Condição B) a energia de ativação desta reação passa a ser +60kJ/mol. Ambas as condições estão descritas graficamente nas figuras abaixo:
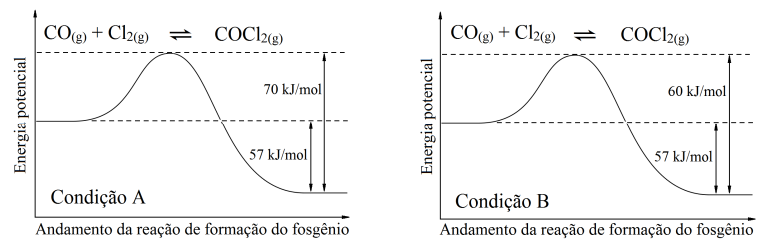
A respeito destes processos, assinale a alternativa correta:
Sob a Condição A, a entalpia da reação inversa é +13kJ/mol, e a Condição B inclui o uso de catalisador, fazendo com que a entalpia da reação inversa passe a ser +3kJ/mol.
Sob a Condição A, a entalpia da reação inversa é +57kJ/mol, e a Condição B inclui o uso de altas temperaturas, fazendo com que a energia de ativação da reação direta passe a ser -10kJ/mol.
Sob a Condição A, a energia de ativação da reação direta é +70kJ/mol, e a Condição B inclui o uso de catalisador, fazendo com que a energia de ativação da reação direta passe a ser +60kJ/mol.
Sob a Condição A, a energia de ativação da reação direta é +13kJ/mol, e a Condição B inclui o uso de catalisador, fazendo com que a energia de ativação da reação direta passe a ser +3kJ/mol.
Sob a Condição A, a energia de ativação da reação direta é +13kJ/mol, e a Condição B inclui o uso de altas temperaturas, fazendo com que a energia de ativação da reação direta passe a ser +3kJ/mol.


