(FUVEST - 2003 - 2 FASE )Em 1861, o pesquisador Ke
(FUVEST - 2003 - 2 FASE ) Em 1861, o pesquisador Kekulé e o professor secundário Loschmidt apresentaram, em seus escritos, as seguintes fórmulas estruturais para o ácido acético ( \(C_2H_4O_2\) ):
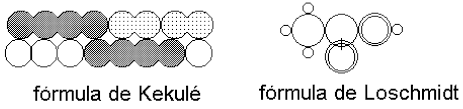
Mais tarde, Lewis introduziu uma maneira, ainda utilizada, de representar estruturas moleculares. Nas fórmulas de Lewis, o total de elétrons de valência dos átomos contribui para as ligações químicas, bem como para que cada átomo passe a ter configuração de gás nobre.
a) Faça uma legenda para as fórmulas de Kekulé e Loschmidt, indicando as figuras utilizadas para representar os átomos de C, H e O.
b) Escreva a fórmula de Lewis do ácido acético.
c) Mostre, usando fórmulas estruturais, as interações que mantêm próximas duas moléculas de ácido acético.


