[IME-2016/2017- 2 fase]A tcnica de Osmometria de P
[IME-2016/2017 - 2ª fase]
A técnica de Osmometria de Pressão de Vapor (OPV) permite determinar a massa molar de uma substância desconhecida através da quantificação da diferença de temperatura (\(\Delta\)T) entre uma gota de solução diluída da substância desconhecida e uma gota do solvente puro utilizado nesta diluição, em câmara saturada com o mesmo solvente, conforme o dispositivo abaixo.
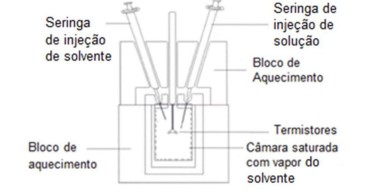
A diferença de temperatura (\(\Delta\)T) tem relação direta com o abaixamento da pressão de vapor (\(\Delta\)P), conforme a expressão:
\(\Delta T=\frac{RT^{2}_{0}}{P_{0}\Delta H_{vap}}.\Delta P\)
em que R = constante universal dos gases ideais, T0 = temperatura de ebulição do solvente puro, P0 = pressão de vapor do solvente puro e \(\Delta\)Hvap = entalpia de vaporização do solvente puro. Demonstre que, segundo a técnica de OPV, a massa molar M1 de uma substância desconhecida pode ser quantificada por:
\(M_{1}=\frac{RT^{2}_{0}}{\Delta H_{vap}}.\frac{W_{1}M_{0}}{\Delta T}\)
em que M0 = massa molar do solvente e W1 = fração mássica do soluto desconhecido na solução diluída.


