(ITA 1997)As notaes e sero utilizadas, respectivam
(ITA 1997)
As notações \( \Delta H_{dis,i}\) e \( \Delta H_{hid,i}\) serão utilizadas, respectivamente, para representar as variações de entalpia molar de dissolução e hidratação da espécie \( i\) em água.
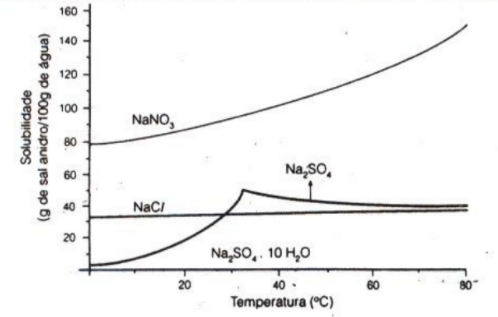
Considerando sistemas termodinamicamente estáveis, é errado afirmar que:
A 25°C, a solubilidade em água do NaNO3 é maior do que a do Na2SO4·10H2O.
A 25°C, uma mistura de 120 g de NaNO3 com 100 g de H2O é bifásica, sendo uma das fases o NaNO3 e a outra a H2O.
A 0°C, uma mistura de 20 g de NaCl com 100 g de água é monofásica, sendo esta fase uma solução aquosa não saturada em NaCl.
A 25°C, a concentração de íons de sódio existentes na fase líquida de uma mistura preparada pela adição de 6 g de NaCl à 100g de H2O é 1 mol/L.
A 25°C, a quantidade (mol) de íons de sódio presentes em uma solução preparada pela dissolução de 1,0 g de Na2SO4 em 10 g de H2O é maior do que a existente em outra solução preparada pela dissolução de 1,0 g de Na2SO4·10H2O na mesma quantidade de água.


