(FUVEST - 2008 - 1 FASE) Certas quantidades de gua
(FUVEST - 2008 - 1ª FASE) Certas quantidades de água comum (\(H_2O\)) e de água deuterada (\(D_2O\)) - água que contém átomos de deutério em lugar de átomos de hidrogênio - foram misturadas. Ocorreu a troca de átomos de hidrogênio e de deutério, formando-se moléculas de HDO e estabelecendo-se o equilíbrio (estado I)
\(H_2O+D_2O\rightarrow 2HDO\)
As quantidades, em mols, de cada composto no estado I estão indicadas pelos patamares, à esquerda, no diagrama. Depois de certo tempo, mantendo-se a temperatura constante, acrescentou-se mais água deuterada, de modo que a quantidade de D2O, no novo estado de equilíbrio (estado II), fosse o triplo daquela antes da adição. As quantidades, em mols, de cada composto envolvido no estado II estão indicadas pelos patamares, à direita, no diagrama.
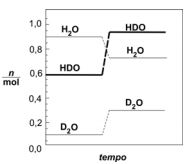
A constante de equilíbrio, nos estados I e II, tem, respectivamente, os valores
0,080 e 0,25
4,0 e 4,0
6,6 e 4,0
4,0 e 12
6,6 e 6,6


