(FUVEST 2008 - 2 fase) Foi montada uma pilha em qu
(FUVEST 2008 - 2ª fase) Foi montada uma pilha em que o pólo positivo era constituído por um bastão de paládio, mergulhado numa solução de cloreto de paládio e o pólo negativo, por um bastão de níquel, mergulhado numa solução de sulfato de níquel. As semi-reações que representam os eletrodos são:
\(Pd^{2+}+2e^- \rightleftharpoons Pd\)
\(Ni^{2+}+2e^- \rightleftharpoons Ni\)
a) Escreva a equação que representa a reação química que ocorre quando a pilha está funcionando (sentido espontâneo).
b) O que acontece com as concentrações de \(Pd^{2+}\) e \(Ni^{2+}\) durante o funcionamento da pilha? Explique.
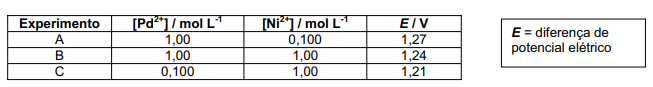
c) Os dados da tabela abaixo sugerem que o princípio de Le Châtelier se aplica à reação química que acontece nessa pilha. Explique por quê.