(UNESP - 2024)A montagem de laboratrio ilustrada n
(UNESP - 2024)
A montagem de laboratório ilustrada na figura destina-se à coleta e medida do volume de produto gasoso gerado numa reação química.
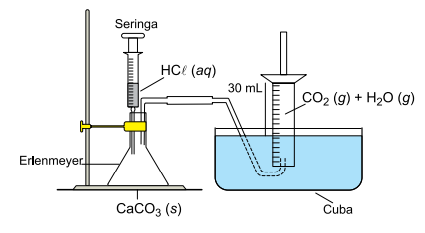
Em um experimento, envolvendo a produção de dióxido de carbono gasoso, CO2 (g), a partir da reação entre carbonato de cálcio, CaCO3 (s), e solução aquosa diluída de ácido clorídrico, HCl (aq), o líquido empregado para a coleta do gás foi a água acidulada. Um comprimido de CaCO3 foi triturado e uma porção do pó resultante foi colocada no erlenmeyer da montagem e posta para reagir com solução de HCl, adicionada a partir da seringa da montagem. Após a reação, o produto gasoso coletado no cilindro graduado teve seu volume determinado, sendo igual a 30 mL. Sabe-se que o produto gasoso recolhido é uma mistura de dióxido de carbono gasoso e vapor de água.
Considerando que o experimento foi realizado sob pressão atmosférica de 726,7 mmHg e temperatura de 27 ºC, que a pressão de vapor da água a 27 ºC é igual a 26,7 mmHg e que a constante universal dos gases, R, é igual a 62,3 mmHg·L · mol-1 · K-1 , a massa de carbonato de cálcio que reagiu na produção de dióxido de carbono gasoso foi de, aproximadamente,
1,0 g.
0,001 g.
0,1 g.
0,01 g.
10 g.


