(UNESP - 2024)Um indicador universal de pH constit
(UNESP - 2024)
Um indicador universal de pH é constituído por uma mistura de indicadores ácido-base que apresentam faixas de pH de viragem e cores diferentes. Um desses indicadores universais é uma solução hidroalcoólica formada pela mistura, em proporções adequadas, dos indicadores alaranjado de metila, vermelho de metila, azul de bromotimol e fenolftaleína. As cores apresentadas por esse indicador em diferentes valores de pH, a 25 ºC, estão ilustradas no quadro.
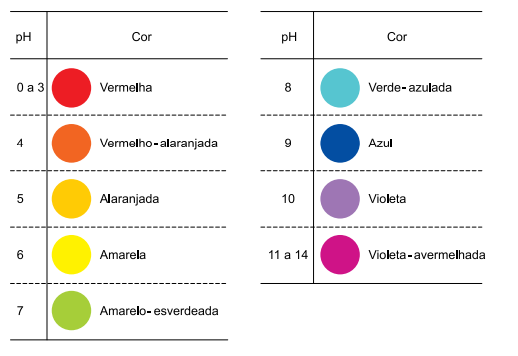
a) Sabendo que o hidróxido de potássio é uma base forte e que o ácido nítrico é um ácido forte, quais serão as cores apresentadas por esse indicador em uma solução aquosa 0,01 mol/L de HNO3 e em uma solução 0,01 mol/L de KNO3?
b) A 25 ºC, o indicador citado apresentou cor violeta ao ser adicionado a uma solução aquosa 0,001 mol/L de hidróxido de amônio. A partir dessa informação e sabendo que o produto iônico da água, Kw, a 25 ºC, é igual a 1 × 10-14, calcule o valor aproximado da constante de ionização, Kb , do hidróxido de amônio.


