(FUVEST - 2002 - 2 FASE)O transporte adequado de o
(FUVEST - 2002 - 2 FASE)
O transporte adequado de oxigênio para os tecidos de nosso corpo é essencial para seu bom funcionamento. Esse transporte é feito através de uma substância chamada oxi-hemoglobina, formada pela combinação de hemoglobina (Hb) e oxigênio dissolvidos no nosso sangue. Abaixo estão representados, de maneira simplificada, os equilíbrios envolvidos nesse processo:
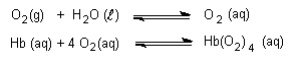
100 mL de sangue contêm por volta de 15 g de hemoglobina e 80 g de água. Essa massa de hemoglobina (15 g) reage com cerca de 22,5 mL de oxigênio, medidos nas condições ambiente de pressão e temperatura.
Considerando o exposto acima,
a) calcule a quantidade, em mols, de oxigênio que reage com a massa de hemoglobina contida em 100 mL de sangue.
b) calcule a massa molar aproximada da hemoglobina.
c) justifique, com base no princípio de Le Châtelier, aplicado aos equilíbrios citados, o fato de o oxigênio ser muito mais solúvel no sangue do que na água.
Dado: volume molar de O2, nas condições ambiente de pressão e temperatura: 25 L/mol


